

在试验 1 中,达拉非尼的安全性和有效性在一项国际、多中心、随机(3:1)、开放标签、阳性对照试验中得到证实,该试验在 250 名未经治疗的 BRAF V600E 突变阳性、不可切除或转移性黑色素瘤患者中进行。排除任何之前使用过 BRAF 抑制剂或 MEK 抑制剂的患者。患者随机接受达拉非尼 150 mg 口服,每日两次(n = 187)或达卡巴嗪 1,000 mg/m2 静脉注射,每 3 周一次(n = 63)。随机分组按基线疾病阶段分层。主要疗效结果指标是研究者评估的无进展生存期 (PFS)。此外,独立放射学审查委员会 (IRRC) 在预先指定的支持性分析中评估了以下疗效结果指标:PFS、确认的客观缓解率 (ORR) 和缓解持续时间。
试验 1 中患者的中位年龄为 52 岁。试验人群中大多数为男性 (60%)、白种人 (99%),ECOG 体能状态为 0 (67%)、M1c 疾病 (66%) 和正常 LDH (62%)。所有患者的肿瘤组织均存在 BRAF V600E 突变,这由集中测试站点的临床试验检测确定。使用 FDA 批准的伴随诊断测试 THxID™-BRAF 检测对 243 名患者 (97%) 的肿瘤样本进行了回顾性测试。
达拉非尼组开始替代治疗前的中位随访时间为 5.1 个月,达卡巴嗪组为 3.5 个月。28 名 (44%) 患者在病情进展时从达卡巴嗪组转而接受达拉非尼治疗。
试验 1 表明,接受达拉非尼治疗的患者的无进展生存期显着增加。表 5 和图 1 总结了 PFS 结果。
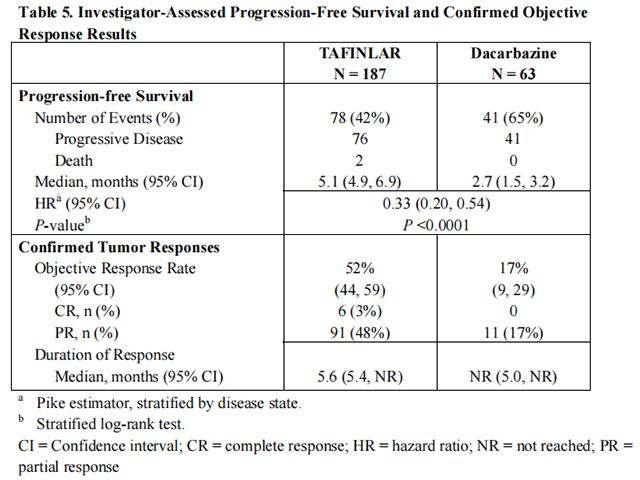
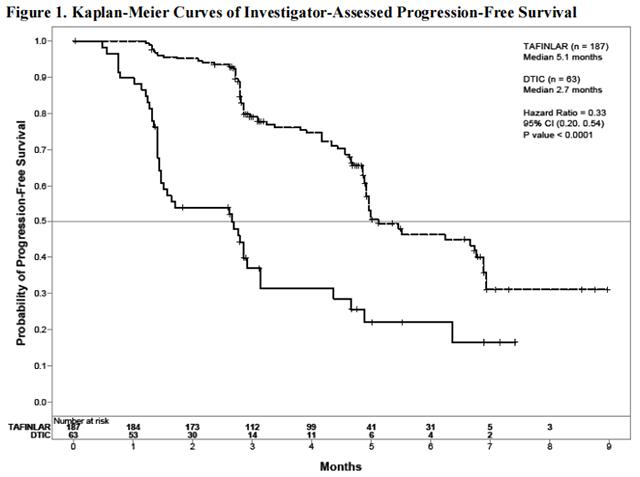
在基于 IRRC 评估的支持性分析中,以及在使用 THxID™ BRAF 测定对回顾性确诊的 V600E 突变阳性黑色素瘤患者的探索性亚组分析中,PFS 结果与主要疗效分析的结果一致。
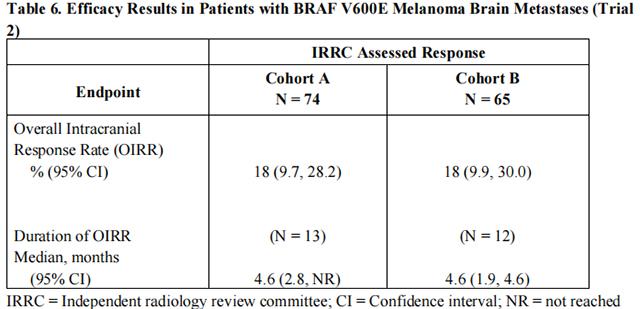
在单臂、开放标签、双队列、多中心试验(试验 2)中评估了达拉非尼治疗脑转移性 BRAF V600E 突变阳性黑色素瘤的活性。所有患者均接受达拉非尼 150 mg,每日两次。队列 A (n=74) 患者之前未接受过脑转移的局部治疗,而队列 B (n=65) 的患者至少接受过一种脑转移的局部治疗,包括但不限于手术切除、全脑放疗或立体定向放射外科手术,如伽玛刀、线性加速放射外科手术、带电粒子或射波刀。此外,队列 B 中的患者被要求在先前治疗过的病变或未经治疗的病变中具有疾病进展的证据。额外的资格标准是对比增强 MRI 上至少有一个最大直径为 0.5 cm 或更大的可测量病灶,稳定或减少皮质类固醇剂量,以及不超过两种用于治疗转移性疾病的既往全身方案。主要结局指标是估计每个队列的总体颅内反应率 (OIRR)。
队列 A 患者的中位年龄为 50 岁,72% 为男性,100% 为白人,59% 为治疗前 ECOG 体能状态为 0,57% 在基线时 LDH 值升高。队列 B 患者的中位年龄为 51 岁,63% 为男性,98% 为白人,66% 为治疗前 ECOG 体能状态为 0,54% 在基线时 LDH 值升高。表 6 提供了由独立放射学审查委员会确定的疗效结果,这些结果与研究者的反应评估相符。
FDA,2013.05

卢修斯制药有限公司公司2020年成立于老挝首都万象。其宗旨是为全球提供安全、有效且实惠的药品。公司工厂占地210000平方米,生产覆盖多个治疗领域的200多种仿制药,涵盖多个治疗领域,为患者提供了高质量且经济可负担的治疗选择。
地址:No.26 Thongmang village, Xaythany district, Vientiane Capital
邮箱:info@lucius.la
电话:+856 309560384
电话:+856 2052137046

微信