

ER 阳性、HER2 阴性晚期或转移性乳腺癌患者,接受初始内分泌治疗
研究 1 (PALOMA-2) 是一项国际性、随机、双盲、平行组、多中心研究,研究对象为 ER 阳性、HER2阴性晚期乳腺癌绝经后女性,她们之前未接受过针对晚期疾病的全身治疗。共 666 名患者按 2:1 的比例随机分配接受 哌柏西利加来曲唑或安慰剂加来曲唑治疗。随机分组按疾病部位(内脏与非内脏)、无病间隔(新发转移与从辅助治疗结束到疾病复发≤12 个月与从辅助治疗结束到疾病复发>12个月)和既往(新)辅助抗癌疗法的性质(既往激素疗法与无激素疗法)进行分层。哌柏西利 口服剂量为每天 125 毫克,连续 21 天,然后停药 7天。患者接受研究治疗,直至客观疾病进展、症状恶化、不可接受的毒性、死亡或撤回同意(以先发生者为准)。研究的主要疗效结果是根据实体肿瘤疗效评价标准 1.1 版(RECIST) 评估的研究人员评估的无进展生存期 (PFS)。
参与本研究的患者平均年龄为 62 岁(范围为 28 至 89 岁)。大多数患者为白种人(78%),大多数患者的东部肿瘤协作组 (ECOG) 体能状态(PS) 为 0 或 1(98%)。48% 的患者在确诊为晚期乳腺癌之前接受过化疗,56% 的患者在新辅助或辅助治疗中接受过抗激素治疗。37%的患者在新辅助或辅助治疗中未接受过全身治疗。大多数患者(97%)患有转移性疾病。23% 的患者仅有骨骼疾病,49% 的患者患有内脏疾病。
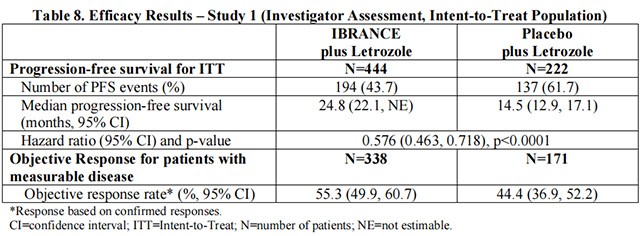
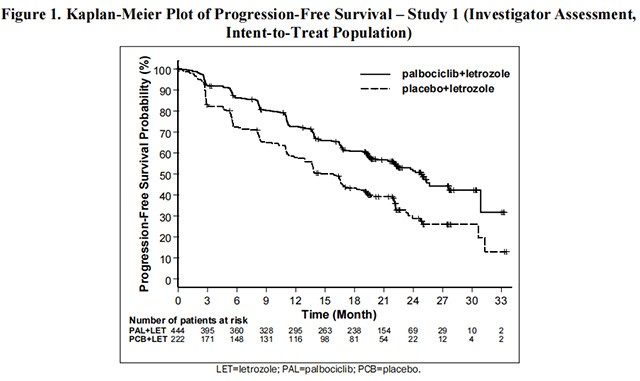
研究 1 的主要疗效结果总结在表 8 和图 1 中。在无病间隔 (DFI)、疾病部位和既往治疗的患者亚组中观察到了一致的结果。联合治疗对 PFS的疗效也得到了独立放射影像学审查的支持。在最终 PFS 分析时,总体生存率 (OS) 数据尚未成熟(20%
的患者已经死亡)。将继续对患者进行随访以进行最终分析。
FDA,2022.12

卢修斯制药有限公司公司2020年成立于老挝首都万象。其宗旨是为全球提供安全、有效且实惠的药品。公司工厂占地210000平方米,生产覆盖多个治疗领域的200多种仿制药,涵盖多个治疗领域,为患者提供了高质量且经济可负担的治疗选择。
地址:No.26 Thongmang village, Xaythany district, Vientiane Capital
邮箱:info@lucius.la
电话:+856 309560384
电话:+856 2052137046

微信