

该队列中有 341 名肿瘤组织入组且具有 PIK3CA 突变的患者,231 名患者入组且没有 PIK3CA 突变。在队列中具有 PIK3CA 突变的 341 名患者中,有 336 名(99%)患者使用 FDA 批准的 therascreen® PIK3CA RGQ PCR 试剂盒在肿瘤组织中确认了一个或多个 PIK3CA 突变。在肿瘤组织中确认的 336 名 PIK3CA 突变患者中,有 19 名患者没有血浆标本可用于使用 FDA 批准的 therascreen® PIK3CA RGQ PCR 试剂盒进行检测。在肿瘤组织中确认的其余 317 例 PIK3CA 突变患者中,177 例患者 (56%) 在血浆标本中发现 PIK3CA 突变,140 例患者 (44%) 在血浆标本中未发现 PIK3CA 突变。
主要疗效结果是研究者根据实体瘤反应评估标准(RECIST)v1.1 在具有 PIK3CA 突变的队列中评估的无进展生存期(PFS)。其他疗效结局指标是具有PIK3CA突变的队列中的总缓解率(ORR)和总生存期(OS)。
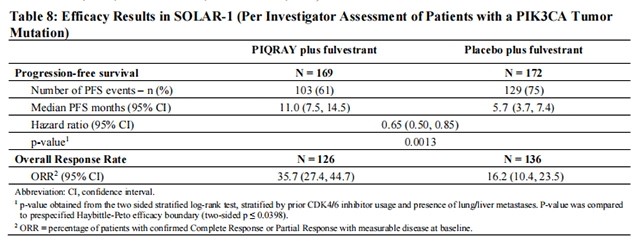
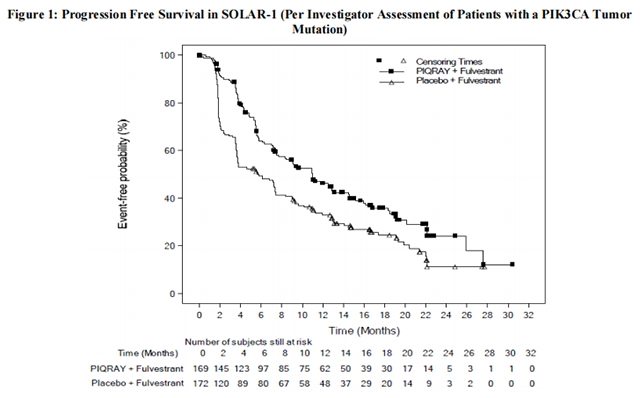
研究者评估的肿瘤组织中具有PIK3CA突变的队列的PFS和ORR结果如表8和图1所示。研究者评估的具有PIK3CA突变的队列的PFS结果得到了盲法独立审查委员会(BIRC)评估的一致结果的支持。在具有组织或血浆PIK3CA突变的患者中也观察到了类似的结果。在预先指定的最终OS分析中,阿培利斯加氟维司群组和安慰剂加氟维司群组在OS方面没有显着差异(风险比[HR]=0.86,95%CI:0.64,1.15)。
在肿瘤没有PIK3CA组织突变的患者中未观察到获益(PFS:HR=0.85,95%CI:0.58,1.25;OS:HR = 0.92,95% CI:0.65,1.29)。
FDA,2022.11

卢修斯制药有限公司公司2020年成立于老挝首都万象。其宗旨是为全球提供安全、有效且实惠的药品。公司工厂占地210000平方米,生产覆盖多个治疗领域的200多种仿制药,涵盖多个治疗领域,为患者提供了高质量且经济可负担的治疗选择。
地址:No.26 Thongmang village, Xaythany district, Vientiane Capital
邮箱:info@lucius.la
电话:+856 309560384
电话:+856 2052137046

微信