

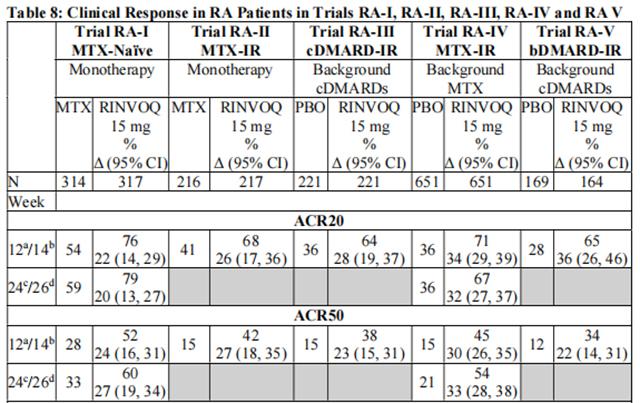
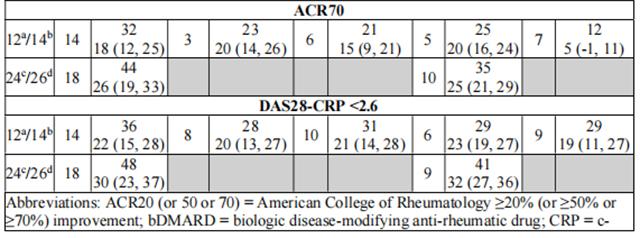
在五项 3 期随机、双盲、多中心试验中评估了乌帕替尼 15 mg,每日一次,在中度至重度活动性类风湿关节炎患者中,并符合 ACR/EULAR 2010 分类标准。18 岁及以上的患者有资格参加。基线时需要存在至少 6 个压痛和 6 个肿胀的关节,以及基于 hsCRP 升高的全身炎症证据。已经研究了其他剂量,但乌帕替尼的推荐剂量为15mg,每日一次。
表8显示了在所有试验中,乌帕替尼治疗的患者达到ACR20、ACR50和ACR70反应以及DAS28(CRP)<2.6的百分比。

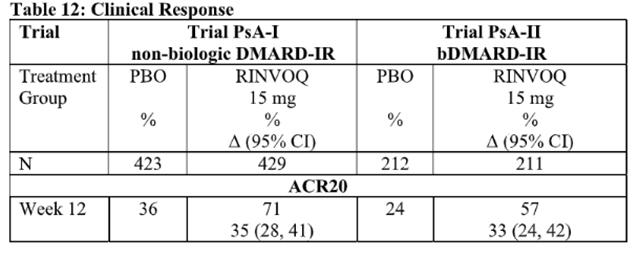
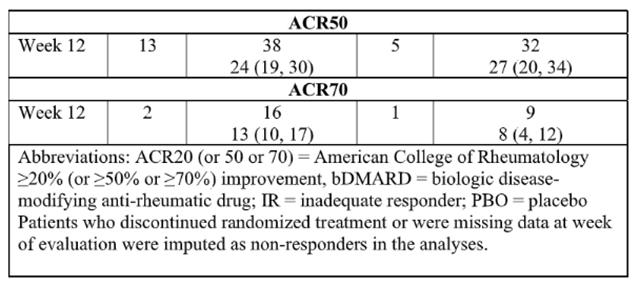
在两项 3 期随机、双盲、多中心、安慰剂对照试验中,在 18 岁或以上患有中度至重度活动性银屑病关节炎的患者中评估了乌帕替尼15 mg(每日一次)的疗效和安全性。根据银屑病关节炎分类标准 (CASPAR),所有患者患有活动性银屑病关节炎至少 6 个月,至少 3 个压痛关节和至少 3 个肿胀关节,以及活动性斑块状银屑病或斑块状银屑病病史。已经研究了另一种剂量,但乌帕替尼的推荐剂量为 15 mg,每日一次,用于银屑病关节炎。
在三项 3 期随机、双盲、多中心试验(AD-1、AD-2、AD-3;NCT03569293、NCT03607422 和 NCT03568318)共计 2584 名患者(12 岁及以上)。乌帕替尼在 344 名患有中度至重度特应性皮炎(AD)的儿科患者和 2240 名患有局部药物未充分控制的中度至重度特应性皮炎(AD)患者中进行了评估。
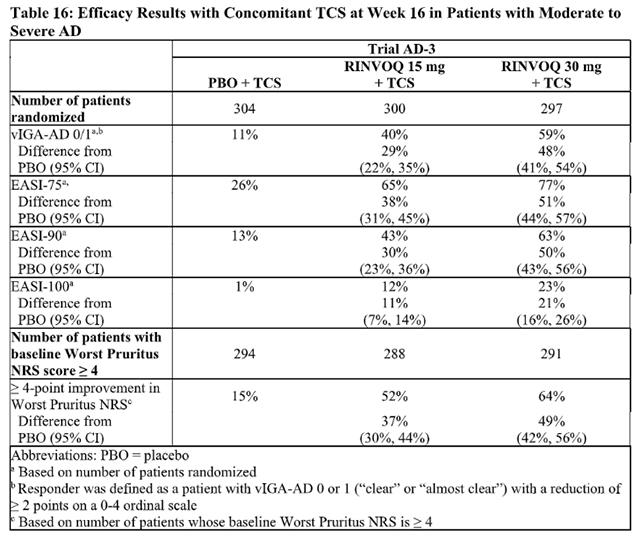
在两项相同的诱导试验中,患者以 2:1 的比例随机分配接受乌帕替尼 45 mg,每日一次或安慰剂,持续 8 周。两项试验共分析了988名患者。这些试验纳入了患有中度至重度活动性溃疡性结肠炎的成年患者,他们对口服氨基水杨酸盐、皮质类固醇、免疫抑制剂和/或生物疗法反应不足、反应丧失或不耐受。入组患者被允许使用稳定剂量的口服氨基水杨酸盐、甲氨蝶呤、溃疡性结肠炎相关抗生素和/或口服皮质类固醇(最多 30 mg/天泼尼松或等效物)。在基线时,38% 的患者正在接受皮质类固醇治疗,68% 的患者正在接受氨基水杨酸盐治疗。禁止伴随生物疗法、硫唑嘌呤、6-巯基嘌呤、静脉注射或直肠皮质类固醇。共有 51% 的患者既往接受过至少一种生物疗法治疗失败或对至少一种生物疗法不耐受。乌帕替尼适用于对一种或多种TNF阻滞剂反应不足或不耐受的患者。
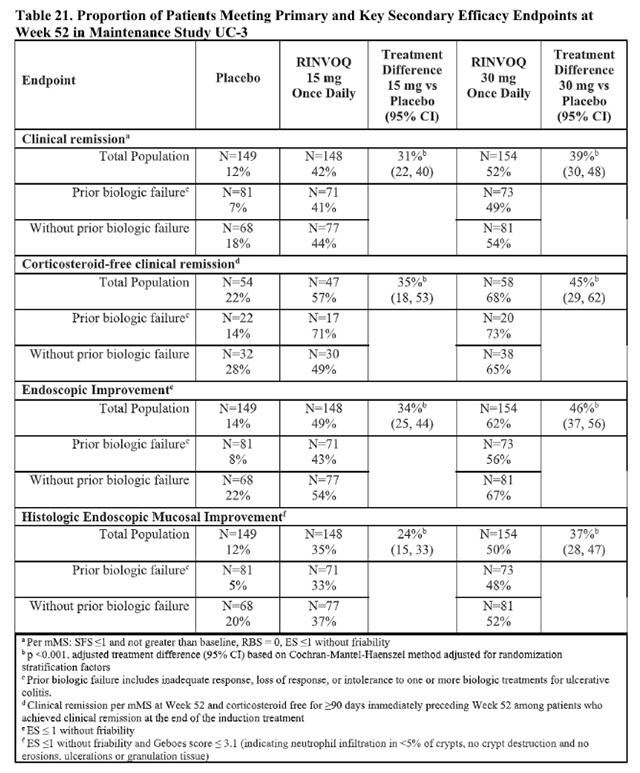
在两项随机、双盲、多中心、安慰剂对照试验中,根据 Bath 强直性脊柱炎疾病活动指数(BASDAI)≥4 和患者对总背痛评分 ≥4 分,在 18 岁及以上的活动性强直性脊柱炎患者中评估了每日一次乌帕替尼 15 mg。
在这两项试验中,与安慰剂相比,接受乌帕替尼15 mg治疗的患者在第14周达到ASAS40反应的比例明显更高(表22,图5)。
在第 14 周时,对性别、基线体重指数(BMI)和基线 hsCRP 的检查未发现这些亚组对乌帕替尼的反应存在差异。
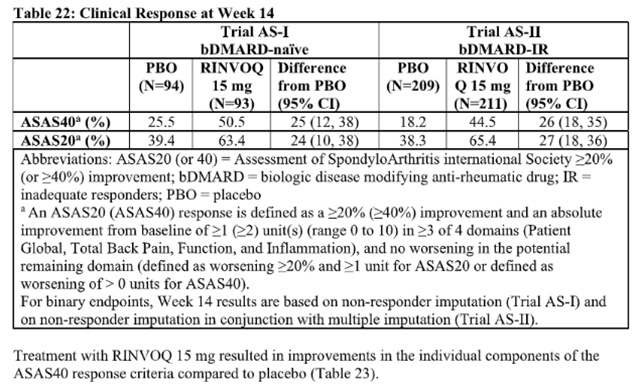
一项随机、双盲、多中心、安慰剂对照试验评估了乌帕替尼15 mg 每日一次的疗效和安全性,试验对象为 18 岁或以上的活动性非放射性中轴型脊柱关节炎患者。试验 nr-axSpA (NCT04169373) 是一项为期 52 周的安慰剂对照试验,试验对象为 314 名活动性非放射性中轴型脊柱关节炎患者(其中 313 名患者接受了研究治疗),这些患者对至少两种非甾体抗炎药 (NSAID) 反应不足或对 NSAID 不耐受或有禁忌症。患者必须有客观的炎症体征,如磁共振成像 (MRI) 上的 C 反应蛋白 (CRP) 升高(定义为 > 正常上限)和/或骶髂关节炎,并且没有骶髂关节结构损伤的确凿放射学证据。患者在筛选和基线访视时患有活动性疾病,定义为巴斯强直性脊柱炎疾病活动指数 (BASDAI) ≥4,并且基于 0 – 10 数值评定量表 (NRS) 的患者总背痛评估评分≥ 4。在基线时,大约 29.1% 的患者同时使用 cDMARD。32.9% 的患者对 bDMARD 治疗反应不足或不耐受。患者每天接受一次 15mg乌帕替尼或安慰剂治疗。主要终点是第 14 周达到国际脊柱关节炎协会 40 评估 (ASAS40) 反应的患者比例。
在 nr-axSpA 试验中,与第 14 周的安慰剂相比,接受乌帕替尼15 mg 治疗的患者中达到 ASAS40 反应的比例显着更高(表 24,图 6)。
第 14 周时,检查性别、基线 BMI、非放射学中轴性脊柱关节炎症状持续时间、基线 hsCRP、MRI 骶髂关节炎和先前使用 bDMARDs 未发现这些亚组对乌帕替尼的反应存在差异。
FDA,2023.04

卢修斯制药有限公司公司2020年成立于老挝首都万象。其宗旨是为全球提供安全、有效且实惠的药品。公司工厂占地210000平方米,生产覆盖多个治疗领域的200多种仿制药,涵盖多个治疗领域,为患者提供了高质量且经济可负担的治疗选择。
地址:No.26 Thongmang village, Xaythany district, Vientiane Capital
邮箱:info@lucius.la
电话:+856 309560384
电话:+856 2052137046

微信